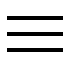pH(ピーエイチ)とは?
pHとは水素イオン濃度(対数表示)を示す
水溶液中(土壌の場合は懸濁液)の水素イオン濃度を示しています。
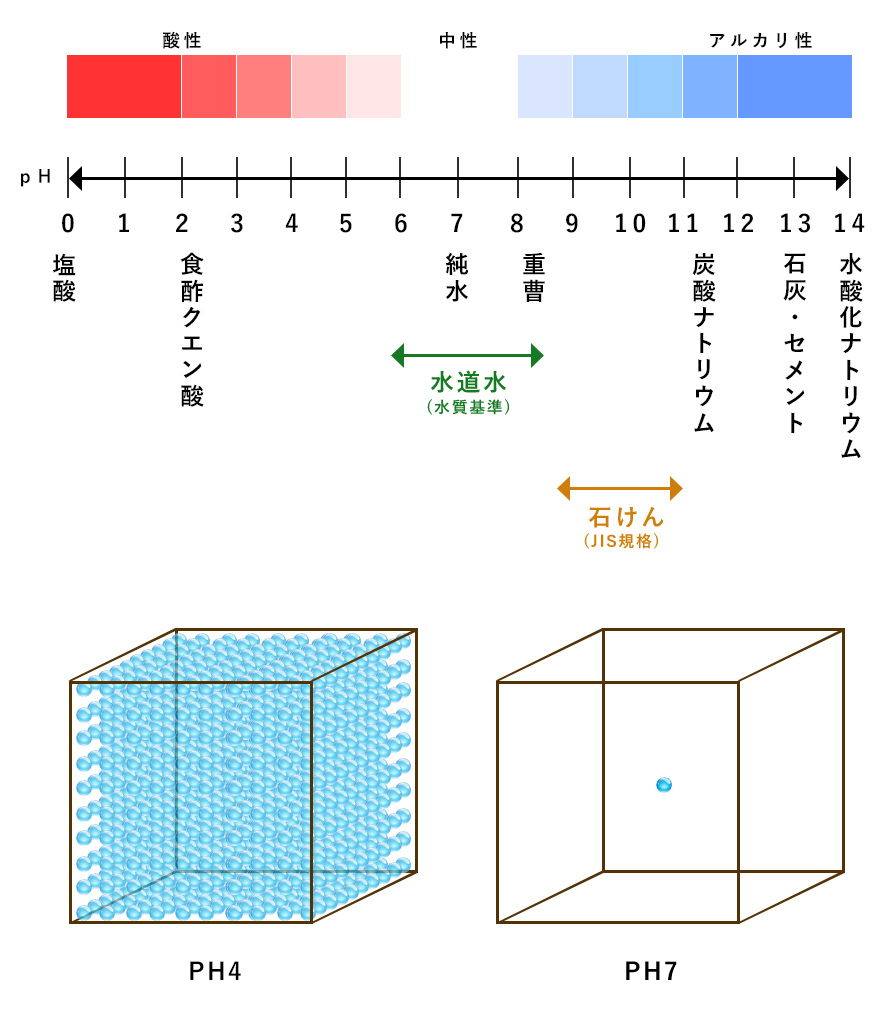
pH=-log10[H+]に示されるように、0~14の対数で表しています。中性が7で、これよりも小さいと酸性、大きくなるとアルカリ性になります。
pH7とpH4では水素イオン濃度が1000倍異なる
pH7とpH4の水素イオン濃度を図示すると左図のようになります。中和は思うほど簡単ではありません。
水溶液と土壌の違い
水溶液の中和反応は瞬時におこります 化学の実験で中和滴定を経験した方は多いと思いますが、水溶液の中和反応は瞬時に起こります。水溶液中には溶けているイオンの量しか存在しないので中和は短時間で安定し、その後のpH値の変化はありません。
土壌の場合、中和反応が安定するまでに150~300時間がかかります。
土壌の場合は含まれているアルカリの原因物質である水酸化カルシウムは僅かしか土壌水(または懸濁液)に溶出しないので中和反応⇒再溶出が繰り返し起こり、pH値のリバウンドが生じます。従って中和剤の配合量はリバウンドが終息した時のpH値から求める必要があり、中和試験には10~14日間程度の時間を要します。